近日����,中國疫苗行業(yè)協(xié)會(huì )和中國標準化協(xié)會(huì )聯(lián)合發(fā)布了《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》團體標準�����?����!都毎委煯a(chǎn)品追溯管理信息系統基本功能規范》標準第一起草單位為北京百奧利盟軟件技術(shù)有限公司�,第一起草人為倪毅��。第一起草單位和起草人組織�����、聯(lián)合多位權威專(zhuān)家共同編制《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》�����,第一起草單位和起草人邀請多位業(yè)內權威專(zhuān)家對《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》進(jìn)行意見(jiàn)征集和預審�,最終形成了標準報批稿�����。
北京百奧利盟軟件技術(shù)有限公司創(chuàng )始人兼總經(jīng)理倪毅介紹道:”多年來(lái)�����,我們始終專(zhuān)注于生命科學(xué)數字化領(lǐng)域��,腳踏實(shí)地�����,步步前行���。從服務(wù)客戶(hù)起步�����,到自主研發(fā)產(chǎn)品�����,再到編制行業(yè)標準����,我們的成長(cháng)與行業(yè)發(fā)展緊密相連����。我們堅信��,通過(guò)不斷完善數字化工具���,我們不僅能為客戶(hù)創(chuàng )造價(jià)值����、提供優(yōu)質(zhì)服務(wù)����,更能推動(dòng)整個(gè)行業(yè)的進(jìn)步���,從而實(shí)現對國家生命科學(xué)領(lǐng)域的數字化轉型貢獻力量��。這是我們的使命���,也是激勵我們不斷前進(jìn)的動(dòng)力�����?��!?/span>


這一標準的制定是對國家藥品監督管理局食品藥品審核查驗中心《細胞治療產(chǎn)品生產(chǎn)質(zhì)量管理指南(試行)》的積極響應�。它為細胞治療產(chǎn)品的追溯系統提供了具體的技術(shù)參考�,有助于實(shí)現產(chǎn)品全生命周期的數字化追溯管理���。這不僅有利于落實(shí)相關(guān)法規要求�,也為行業(yè)的規范化發(fā)展提供了支持����。
《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》標準編制團隊和預審團隊涵蓋細胞治療領(lǐng)域和地域廣泛�,包括細胞與基因數字化專(zhuān)家�,大型生物藥企的運營(yíng)負責人和信息部門(mén)負責人�、大型研究型醫院業(yè)務(wù)負責人和信息部門(mén)負責人��、細胞治療企業(yè)負責人�。
起草人和單位
倪毅(北京百奧利盟軟件技術(shù)有限公司創(chuàng )始人/總經(jīng)理)
華堅(上海醫藥集團生物治療技術(shù)有限公司總經(jīng)理)
邵揚(上海醫藥集團信息中心主任)
衡反修(北京大學(xué)腫瘤醫院信息部主任)
沈東炎(廈門(mén)大學(xué)附屬第一醫院精準醫療中心主任)
胡欣(復旦大學(xué)附屬腫瘤醫院精準醫療中心主任)
羅敏(廣州百暨基因科技有限公司總經(jīng)理)
王婷婷(廣州來(lái)恩生物醫藥有限公司首席運營(yíng)官)
預審專(zhuān)家(按姓氏拼音排序)
李秀玲?(上海生物制品研究所有限責任公司總經(jīng)理)
劉雅容?(沙礫生物聯(lián)合創(chuàng )始人/CEO)
羅林云?(中國生物技術(shù)股份有限公司營(yíng)銷(xiāo)中心副總經(jīng)理)
陸家海?(國家藥品監督管理局疫苗及生物制品質(zhì)量監測與評價(jià)重點(diǎn)實(shí)驗室主任)
錢(qián)其軍?(上海細胞治療集團董事長(cháng)兼CEO)
齊菲菲?(北京藝妙神州醫藥科技有限公司聯(lián)合創(chuàng )始人/CTO)
田正隆?(高博臨床研究中心首席戰略官兼首席數據官)
王立群(星奕昂(上海)生物科技有限公司創(chuàng )始人/董事長(cháng)兼CEO�����,副總裁袁歆代)
徐靜?(中國生物研究院副院長(cháng))
張丹?(江蘇譜新生物醫藥有限公司聯(lián)合創(chuàng )始人)
2023年7月 標準申報-工作組討論稿??
2023年9月 合規性審查-工作組討論稿
2024年3月 正式立項-征求意見(jiàn)稿
2024年3-4月 征求意見(jiàn)-征求意見(jiàn)稿
2024年4月 預審-送審討論稿
2024年5月 會(huì )審-報批稿
2024年5月 中國生物制品大會(huì )公示-報批稿
2024年6月 結束公示
2024年7月12日 中國疫苗行業(yè)協(xié)會(huì )�����、中國標準化協(xié)會(huì )聯(lián)合發(fā)布-正式文件


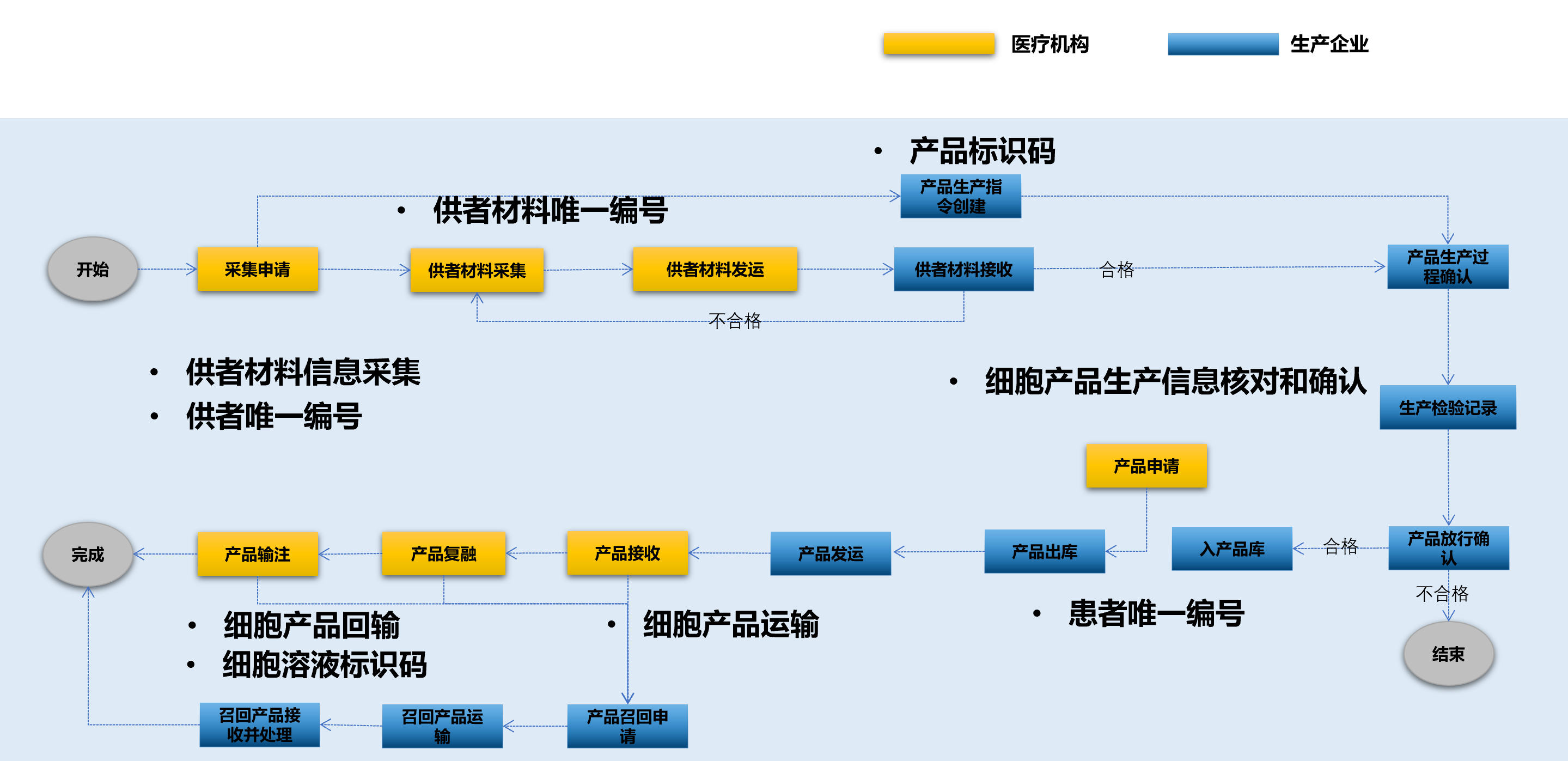
《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》依據《細胞治療產(chǎn)品生產(chǎn)質(zhì)量管理指南(試行)》第十一章產(chǎn)品追溯系統����,細胞治療產(chǎn)品范圍包括按藥品批準上市的經(jīng)過(guò)適當的體外操作(如分離���、培養�、擴增���、基因修飾等)而制備的人源活細胞產(chǎn)品�,包括經(jīng)過(guò)或未經(jīng)過(guò)基因修飾的細胞����,如自體或異體的免疫細胞�����、干細胞�、組織細胞或細胞系等產(chǎn)品�。標準適用于細胞產(chǎn)品從供者材料的采集�、運輸���、接收����、產(chǎn)品生產(chǎn)和檢驗到成品放行��、儲存�����、運輸和使用的全過(guò)程����。
《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》標準規定了細胞治療產(chǎn)品追溯管理信息系統的定義��、適用范圍以及功能要求����。標準適用于細胞治療產(chǎn)品追溯管理信息系統的規劃�����、設計���、開(kāi)發(fā)����、應用和評價(jià)�。
《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》標準主要內容包括:
1. 系統管理:規定了用戶(hù)管理�����、角色權限�、產(chǎn)品類(lèi)型���、審計追蹤等基礎功能���,為系統的安全性和可追溯性奠定基礎����。
2. 供者材料采集與運輸:詳細規定了從供者材料采集申請到運輸全過(guò)程的管理要求�,確保供者材料的可追溯性���。
3. 產(chǎn)品生產(chǎn):涵蓋了從供者材料接收到產(chǎn)品放行的全過(guò)程���,實(shí)現生產(chǎn)環(huán)節的全程可控���。
4. 產(chǎn)品存儲��、申請與運輸:規定了產(chǎn)品入庫���、出庫����、運輸計劃等環(huán)節的管理要求����,保證產(chǎn)品流轉過(guò)程的可追蹤��。
5. 產(chǎn)品使用:包括產(chǎn)品接收�����、復融和輸注等環(huán)節�,確保產(chǎn)品使用過(guò)程的安全性和可追溯性�。
6. 產(chǎn)品召回:規定了產(chǎn)品召回的全流程管理�����,提高了不良事件的應對能力���。
7. 產(chǎn)品信息追溯:支持通過(guò)多種標識碼查詢(xún)產(chǎn)品全生命周期信息���,實(shí)現了全方位的追溯能力�����。
《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》標準的發(fā)布對細胞治療產(chǎn)品追溯具有重要意義:
1. 實(shí)現全程可追溯:通過(guò)統一的信息系統���、用于標識供者材料和產(chǎn)品的唯一性的編號���,實(shí)現從供者材料采集到產(chǎn)品使用的全過(guò)程追溯���,實(shí)現產(chǎn)品從供者到患者或從患者到供者的雙向追溯����。
2. 實(shí)現數據防混淆:在從供者材料采集到產(chǎn)品使用的全過(guò)程中�����,確??勺R別供者且具有唯一性的編號不會(huì )發(fā)生標識錯誤或遺漏�,確保供者材料或細胞產(chǎn)品與患者之間的匹配性�。
3. 提高數據安全性:通過(guò)嚴格的身份認證��、權限管理和審計追蹤����,保障了系統和數據的安全性�����,同時(shí)也保護了供者和患者的隱私��。
4. 規范行業(yè)標準:為細胞治療產(chǎn)品追溯管理信息系統的開(kāi)發(fā)和應用提供了統一的標準�����,有利于行業(yè)的規范化發(fā)展����。
5. 落實(shí)法規要求:該標準源于《細胞治療產(chǎn)品生產(chǎn)質(zhì)量管理指南(試行)》�,將法規要求具體化����、操作化��,便于企業(yè)和醫療機構執行��。
6. 提升應急能力:通過(guò)完善的召回機制�,提高了對不良事件的快速響應能力�,最大限度地保障患者安全����。
《細胞治療產(chǎn)品追溯管理信息系統基本功能規范》標準的發(fā)布���,是我國細胞治療領(lǐng)域質(zhì)量管理體系建設的重要一步��。這一標準為產(chǎn)品追溯系統提供了具體的技術(shù)參考�����,有助于企業(yè)更好地落實(shí)相關(guān)法規要求����。它不僅為行業(yè)提供了可操作的參考����,也為提升細胞治療產(chǎn)品全生命周期的可追溯性創(chuàng )造了條件����。我們期待看到�����,隨著(zhù)這一標準的逐步實(shí)施���,細胞治療產(chǎn)品質(zhì)量管理和患者安全保障方面取得新的進(jìn)展�。