AML是一種具有高度異質(zhì)性的血液系統惡性腫瘤����,且主要為一種老年患者疾病����,診斷時(shí)的中位年齡為68歲1��。美國國家癌癥所最新的SEER(Surveillance Epidemiology and End Results Program)預估數據顯示�,2020年美國將有19940例新診AML病例����,并將有11180人死于該疾病��。盡管近年來(lái)在A(yíng)ML的治療方面取得了一定進(jìn)展���,但該疾病的5年生存率為25%-30%�����,因此臨床上仍迫切需要更安全�、更持久有效的治療手段�。
“孤兒藥”又稱(chēng)為罕見(jiàn)藥����,指用于預防�����、治療�����、診斷罕見(jiàn)病的藥品�。在美國�,罕見(jiàn)疾病是指患病人數少于20萬(wàn)人的疾病�����。自1983年以來(lái)�,美國通過(guò)《孤兒藥法案》的實(shí)施���,給予企業(yè)相關(guān)政策扶持�,以鼓勵罕見(jiàn)病藥品的研發(fā)����。獲得美國FDA授予的孤兒藥資格認定����,將有助于該藥物在美國的后續研發(fā)及商業(yè)化開(kāi)展等方面享受一定的政策支持�����,包括享有臨床試驗費用稅收減免�、免除NDA申請費用���、獲得研發(fā)資助等�����,特別是該藥物該適應癥批準上市后可獲得美國市場(chǎng)7年獨占權�����。
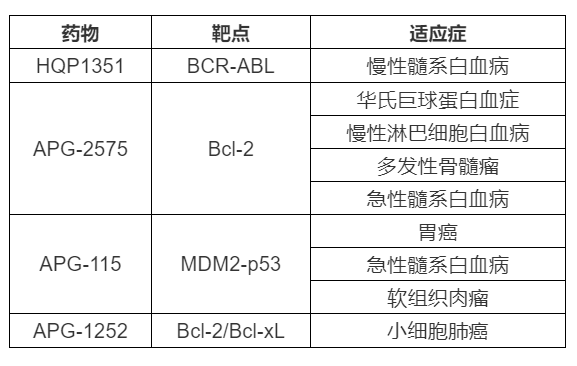
隨著(zhù)中國醫藥創(chuàng )新力量的崛起����,中國藥企近年來(lái)的“出?!壁厔萑找婷黠@���,獲得FDA孤兒藥認定等資格認定也被視為重要的全球化創(chuàng )新實(shí)力指標之一��。作為一直堅持全球創(chuàng )新的領(lǐng)軍企業(yè)����,亞盛醫藥無(wú)疑是其中佼佼者��。截至現在�����,亞盛醫藥共有4個(gè)在研新藥獲得9項FDA孤兒藥認證(見(jiàn)下表)����。公開(kāi)信息顯示�,該數量在中國企業(yè)中最為領(lǐng)先���。
FDA批準的創(chuàng )新藥數量的公開(kāi)數據顯示�,近10年來(lái)�����,獲得FDA批準的孤兒藥在獲批創(chuàng )新療法中的比例逐步上升�����。2020年全年獲批新藥中獲孤兒藥資格的創(chuàng )新療法的比例超過(guò)了60%�,創(chuàng )10年來(lái)占比的新高����。這一數據表明��,FDA孤兒藥資格認定的政策對于加快罕見(jiàn)病藥物的研發(fā)��、上市有著(zhù)非常實(shí)際的激勵與推動(dòng)意義���。
亞盛醫藥董事長(cháng)�����、CEO楊大俊博士表示:“我們在短短一年時(shí)間內���,獲得9項FDA孤兒藥認證���,無(wú)論在時(shí)間還是數量上�,都是創(chuàng )下中國企業(yè)之最����,甚至在全球范圍內也應該是領(lǐng)先的�����。這一數據的背后��,源于我們團隊對于自身使命的堅守����,即‘解決中國乃至全球患者尚未滿(mǎn)足的臨床需求’�����。希望在FDA孤兒藥政策的推動(dòng)下��,我們的多個(gè)藥物能加快臨床開(kāi)發(fā)進(jìn)度�,早日獲批�����,從而更快的造福更多患者�����?�!?/span>
參考文獻
1.????DeSantis CE, Lin CC, Mariotto AB, et al. Cancer Treatment and Survivorship Statistics, 2014. CA Cancer J Clin 2014;64:252-271.
關(guān)于亞盛醫藥
亞盛醫藥是一家立足中國�、面向全球的處于臨床開(kāi)發(fā)階段的原創(chuàng )新藥研發(fā)企業(yè)���,致力于在腫瘤����、乙肝及與衰老相關(guān)的疾病等治療領(lǐng)域開(kāi)發(fā)創(chuàng )新藥物���。2019年10月28日����,亞盛醫藥在香港聯(lián)交所主板掛牌上市����,股票代碼:6855.HK�����。
亞盛醫藥擁有自主構建的蛋白-蛋白相互作用靶向藥物設計平臺����,處于細胞凋亡通路新藥研發(fā)的全球最前沿��。公司已建立擁有8個(gè)已進(jìn)入臨床開(kāi)發(fā)階段的1類(lèi)小分子新藥產(chǎn)品管線(xiàn)����,包括抑制Bcl-2���、IAP 或 MDM2-p53 等細胞凋亡路徑關(guān)鍵蛋白的抑制劑����;新一代針對癌癥治療中出現的激酶突變體的抑制劑等�,為全球唯一在細胞凋亡路徑關(guān)鍵蛋白領(lǐng)域均有臨床開(kāi)發(fā)品種的創(chuàng )新公司����。目前公司正在中國����、美國及澳大利亞開(kāi)展40多項I/II期臨床試驗�����。用于治療耐藥性慢性髓性白血病的核心品種HQP1351已在中國遞交新藥上市申請����,該品種獲得了美國FDA審評快速通道及孤兒藥認證資格���。截至目前�,公司共有4個(gè)在研新藥獲得9項FDA孤兒藥資格認證����。