JSI-1187的I期臨床試驗是一項開(kāi)放標簽�、多中心劑量遞增和擴展臨床研究����,在攜帶MAPK突變的復發(fā)�、難治性實(shí)體腫瘤患者中評估JSI-1187的安全性�����、耐受性��、藥代動(dòng)力學(xué)�、藥理動(dòng)力學(xué)和臨床藥效��。該臨床研究包括3個(gè)階段:1)JSI-1187單藥劑量爬坡階段���,用于實(shí)體腫瘤患者�;2)JSI-1187與BRAF抑制劑達拉非尼聯(lián)用的劑量爬坡���;3)對攜帶特定基因突變腫瘤患者的擴展研究�����。
負責JSI-1187項目開(kāi)發(fā)的首席開(kāi)發(fā)官Linda Paradiso博士表示:“JSI-1187是選擇性ERK1/2激酶抑制劑��,我們希望通過(guò)ERK抑制劑來(lái)對抗攜帶MAPK通路突變的腫瘤���,能夠開(kāi)發(fā)更有效的單藥和聯(lián)合療法���,在耐藥產(chǎn)生早期階段防止和解決目前已有的MAPK通路靶向藥常見(jiàn)的耐藥問(wèn)題'��。
捷思英達首席執行官張勁濤博士表示:“JSI-1187臨床試驗的啟動(dòng)對捷思英達是一個(gè)非常重要的里程碑��。JSI-1187是捷思英達首個(gè)自主創(chuàng )新研發(fā)并進(jìn)入臨床研究的抗癌新藥�����,從項目立項到進(jìn)入臨床試驗����,總共耗費約三年時(shí)間�。在抗擊新冠疫情�����,確保安全的前提下�����,捷思英達和合作單位共同努力���,先后在美國國家癌癥研究院(NCI)指定的四家綜合性癌癥中心啟動(dòng)了臨床試驗�����。我們期待JSI-1187能為腫瘤患者帶來(lái)福音���?���!?/span>
JSI-1187是由捷思英達自主開(kāi)發(fā)的口服高選擇性ERK1/2小分子激酶抑制劑�����,在臨床前模型中對MAPK 通路突變的腫瘤顯示出高度抑制性����。通過(guò) RAS-RAF-MEK-ERK 級聯(lián)的 MAPK 信號在癌癥生長(cháng)和增殖中起著(zhù)至關(guān)重要的作用�����。MAPK/ERK 通路的突變存在于多種癌癥類(lèi)型中�����,包括胰腺癌(+90%)���、膽道癌(3-50%)�、結直腸癌(30-50%)����、肺癌(25-30%)�、卵巢癌(15-39%)和子宮內膜 (18%)中的KRAS突變����,以及黑色素瘤 的NRAS突變 (20%)和BRAF V600突變(50%)等��。雖然BRAF/MEK抑制劑靶向聯(lián)合療法在黑色素瘤和其他癌癥中比單藥具有更顯著(zhù)的藥效���,但大多數患者最終都會(huì )產(chǎn)生耐藥性和疾病進(jìn)展���。在已發(fā)現的耐藥機制中���,關(guān)鍵是ERK激酶的重新激活��。因此�,ERK 抑制具有避免或克服耐藥的潛力���。
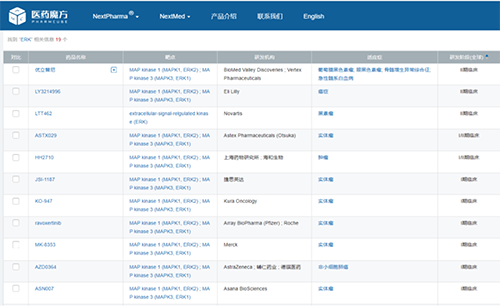
目前全球尚無(wú)ERK激酶抑制劑獲批上市�����,進(jìn)展最快的項目也僅處于II期階段��,包括優(yōu)立替尼(BioMed Valley Discoveries/Vertex)���、LY3214996(禮來(lái))�、LTT462(諾華)���。JSI-1187于2020年1月獲得美國FDA臨床申請許可���,2020年6月在美國啟動(dòng)臨床I期試驗(臨床試驗登記號為:NCT04418167)�。
來(lái)源:NextPharma
關(guān)于捷思英達
捷思英達位于上海張江科學(xué)城國際醫學(xué)園區����,專(zhuān)注于小分子原創(chuàng )抗癌新藥的研發(fā)��。捷思英達在上海張江國際醫學(xué)園區擁有包括動(dòng)物房在內的新藥探新研究技術(shù)平臺����,在美國波士頓設有負責項目引進(jìn)和臨床開(kāi)發(fā)的子公司�。捷思英達采用自主研發(fā)和項目引進(jìn)齊頭并進(jìn)的“雙輪驅動(dòng)”商業(yè)模式�����,加快研發(fā)管線(xiàn)的建立���。公司研發(fā)團隊及時(shí)應用國際知名臨床專(zhuān)家最新發(fā)現的藥物作用機制�����,開(kāi)展國際首創(chuàng )的抗癌新藥研發(fā)���,努力解決國內外腫瘤患者高度未滿(mǎn)足的臨床需求����。