近日�����,沙礫生物的全球首款膜結合IL-15復合物編輯型TIL(腫瘤浸潤淋巴細胞)產(chǎn)品GT201注射液�����,取得重要里程碑式進(jìn)展�。近日����,GT201繼2023年7月獲批中國IND后���,又接連獲得了美國FDA的IND批準�����,開(kāi)啟了沙礫生物在美國海外市場(chǎng)開(kāi)展臨床試驗的新篇章�。
GT201注射液在中國的1期臨床研究中展現出良好的安全性和臨床療效����,相關(guān)臨床研究成果已經(jīng)在2024年美國臨床腫瘤學(xué)會(huì )年會(huì )(ASCO 2024)進(jìn)行了展示(點(diǎn)擊訪(fǎng)問(wèn))��。以下為GT201的簡(jiǎn)要介紹以及臨床數據的總結�����。
TIL療法在多種實(shí)體瘤中顯示出良好的治療效果��,并顯著(zhù)延長(cháng)了晚期患者的生存期�����。然而TIL細胞在大規模擴增過(guò)程中����,會(huì )產(chǎn)生細胞功能降低或耗竭的情況�����,從而影響抗腫瘤效果和長(cháng)期療效�。為此���,沙礫生物設計了一種基因工程TIL產(chǎn)品GT201��,該產(chǎn)品過(guò)表達一種提高T細胞功能的膜結合型IL-15復合物�����,從而增強TIL細胞的體內存續性和抗腫瘤能力����。
GT201在設計上�����,不同于其他過(guò)表達分泌型或者膜結合型IL-15的細胞產(chǎn)品�,選擇了過(guò)表達膜結合型的IL-15/IL-15Ra復合物�,該設計使得GT201在保持良好的安全性情況下����,進(jìn)一步提升其功能��,從而提高在更多實(shí)體腫瘤適應癥中的治療效果��。
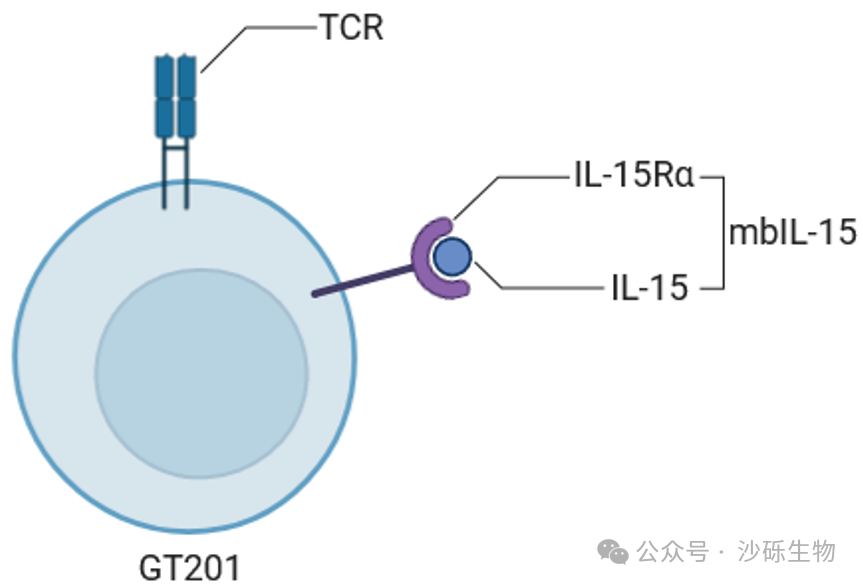
Fig: GT201的結構設計示意圖
安全性方面���,GT201安全性良好��,未觀(guān)察到與GT201 TIL細胞直接相關(guān)的SAE����。所有不良反應在14天內消失�����、或降為2級或更低����。臨床療效方面����,多例患者的腫瘤明顯縮小且病情緩解���,其中一名患者接受GT201治療后��,腫瘤相比治療前減少了69%��。在所有的非小細胞肺癌患者中����,GT201的疾病控制(腫瘤部分消除或病情穩定超過(guò)24周)率達到100%����。另外在細胞存續方面�����,輸注GT201的TIL后���,T細胞在所有患者中穩定擴增����,并且GT201細胞在患者體內擴增并存續的時(shí)間超過(guò)6個(gè)月�����。
對于多線(xiàn)治療的晚期或轉移實(shí)體瘤患者�����,沙礫生物的GT201注射液展示出可控的安全性和良好的臨床療效���。
與此同時(shí)���,沙礫生物的另一項非基因編輯的GT101注射液�,也已經(jīng)在中國正式開(kāi)啟關(guān)鍵II期臨床研究��,后續將在全國多家臨床中心陸續進(jìn)行復發(fā)或轉移性宮頸癌受試者招募�����;沙礫生物的GT201等其它管線(xiàn)�,也正在全國各地的醫院研究中心招募轉移/復發(fā)晚期實(shí)體瘤患者���。
沙礫生物成立于2019年�,是一家專(zhuān)注于腫瘤免疫細胞治療���,以TIL藥物為代表研發(fā)管線(xiàn)的創(chuàng )新型醫藥公司�。沙礫生物已完成多輪股權融資�����,得到了國內外多家知名創(chuàng )投基金的支持��。
沙礫生物自主研發(fā)的GT101注射液是國內首個(gè)獲批注冊臨床的TIL藥物����,目前進(jìn)入關(guān)鍵二期臨床試驗����。沙礫生物的全球首款膜結合IL-15復合物編輯型TIL產(chǎn)品GT201注射液�����,已經(jīng)完成了中美臨床雙報����。公司的核心研發(fā)平臺包括StemTexp?干性TIL擴增技術(shù)平臺���、StaViral?病毒穩轉株工藝�、ImmuT Finder?免疫調節靶點(diǎn)發(fā)現平臺�����、KOReTIL?高效基因敲除系統���,并依托平臺開(kāi)發(fā)了一系列下一代基因編輯型TIL藥物�����。沙礫生物擁有國際領(lǐng)先的技術(shù)儲備和產(chǎn)業(yè)資源����,旨在打造開(kāi)創(chuàng )性的實(shí)體瘤細胞藥物�,為廣大腫瘤病患帶來(lái)新的希望��。